TBK1的酪氨酸激酶PTK2B促进STING和TBK1的寡聚化
2023年11月21日,中国科学院动物所、北京干细胞与再生医学研究院孙钦秒和云南大学陈大华团队在Nature communications期刊发表一篇名为“PTK2B promotes TBK1 and STING oligomerization and enhances the STING-TBK1 signaling”的研究,该研究发现蛋白酪氨酸激酶2B(PTK2B)作为TBK1的互作蛋白,可以磷酸化TBK1,促进TBK1的寡聚化、STING的寡聚化,以及下游信号转导介导的抗病毒先天免疫反应。
TBK1是先天性免疫反应中的一个关键激酶。它能使IRF3/7磷酸化,诱导其二聚化和核转位,进而诱导IFN的产生。先前的研究表明,TBK1磷酸化对其激活非常重要。例如,研究发现AKT1可使TBK1在S510残基上磷酸化,从而降低TBK1的活化,而蛋白磷酸酶PPM1A和PPM1B可清除TBK在丝氨酸残基上的磷酸化,从而降低其活化。除了丝氨酸残基,研究还发现TBK1在酪氨酸(Tyr)上的磷酸化也能调节其活化。酪氨酸激酶Lck/Hck/Fgr直接使TBK1在Y354和Y394残基上磷酸化,从而降低其活化程度。与此相反,酪氨酸激酶SRC可增强TBK1的自身磷酸化和活化。然而,目前没有证据表明SRC可直接使TBK1磷酸化。
先前的研究说明,蛋白质寡聚化在先天性免疫反应中起着关键作用,蛋白质磷酸化可改变其低聚物状态,并可能影响其在细胞中的功能。据报道,GSK3β可促进TBK1的寡聚化,进而影响其自身磷酸化和活化,而酪氨酸激酶Lck/Hck/Fgr可使TBK1在Tyr残基上磷酸化,从而降低TBK1的二聚化和活化。这些发现表明,TBK1的磷酸化可能会改变其结构构象,然后调节其寡聚体的形成,从而调节其活性。然而,TBK1磷酸化与寡聚体形成之间的确切调控关系在很大程度上仍不为人所知。
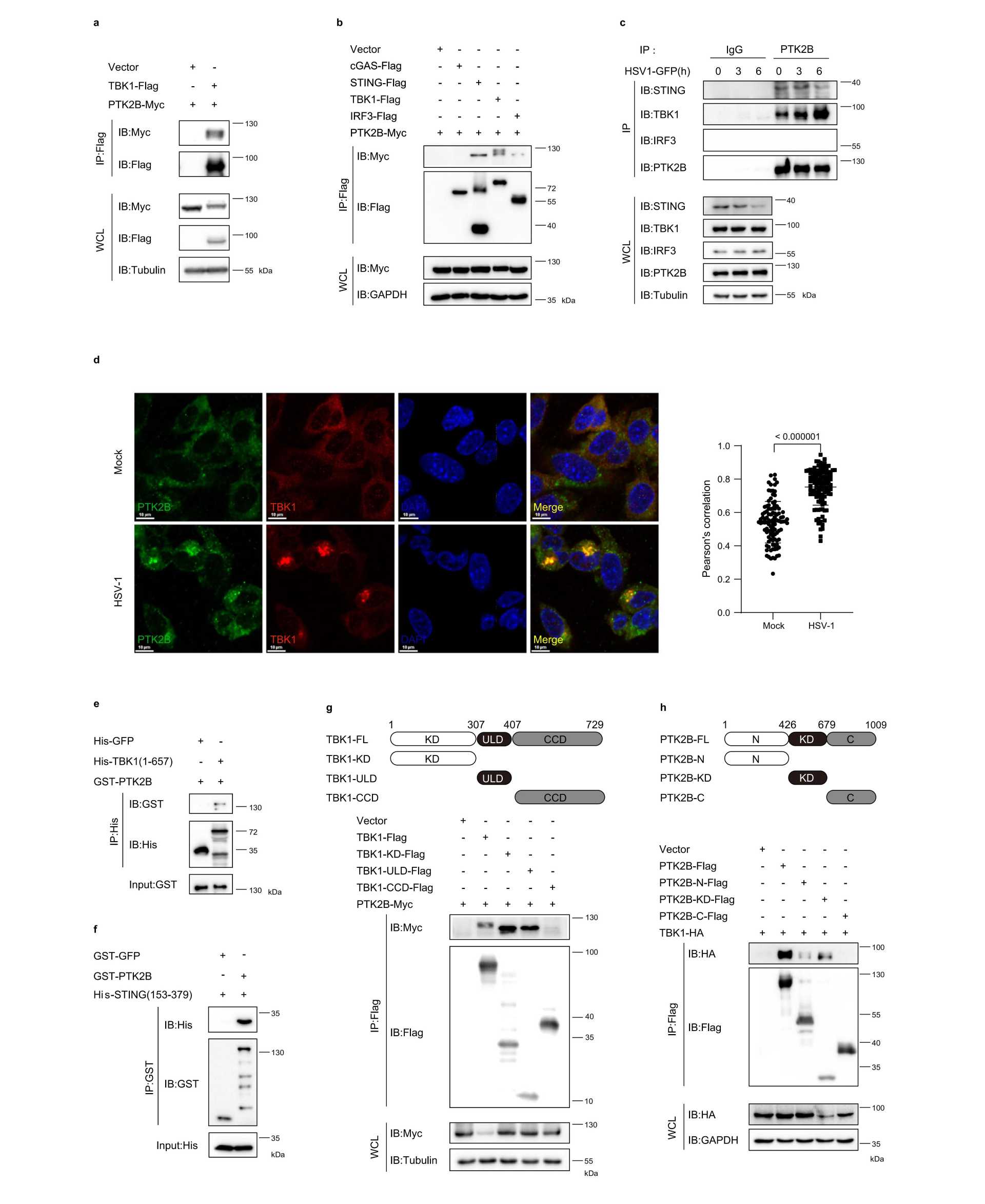
Fig. 1 PTK2B interacts with TBK1 and STING.
原文链接:https://www.nature.com/articles/s41467-023-43419-4
