3D打印器官:我们离“换肾自由”还有多远?
3D打印算得上是近年来的一项网红技术了,随着此技术的不断成熟和普及,3D打印逐渐从实验室走进工厂、医院、教室,再逐步走进平民百姓的日常生活。汽车、飞机、衣帽、首饰、玩具……现在已然是一个“万物皆可打印”的时代,甚至当我们仰望星空,中国空间站和国际空间站上的3D打印设备也在帮助我们完成星辰大海的梦想。然而3D打印的宏图可能才刚刚展开,未来的3D打印技术将继续给我们带来低成本、高质量的产品,特别是在生命科学和医疗领域,3D打印将用于体外制造人体器官,带给人类“换肾自由”。今天我们就来介绍一下3D打印的起源、发展、未来,以及在制造器官中的瓶颈。
1. 起源:从活字印刷到2D打印
故事可能要从1041年毕昇发明活字印刷术讲起,这是印刷史上第一次引入类似像素的概念,通过任意单字的排列组合,使得印刷过程变得更灵活和高效。而后元朝的王桢将泥板活字改进为木制活字,还发明了转轮排字架来进一步提高排版和印刷的效率,降低了印刷的成本。
大约400年后,德国人约翰·古腾堡(Johannes Gutenberg)发明了手工驱动的铅活字印刷机(又称谷腾堡印刷机),推进了印刷术的工业化和印刷品的普及,这也成为了文艺复兴运动的重要推动力。印刷技术又经历了蒸汽动力、排版机等技术革新,直到上世纪六七十年代,OKI公司、施乐公司,和佳能公司先后发明了针式打印机、激光打印机,和喷墨打印机,在二维平面上输出文本或图片等信息的2D打印技术基本大成,直到今天我们常用的也就是喷墨打印机和激光打印机了,或许大家去派出所的时候还能看见针式打印机的身影。
2. 兴起:3D制造技术革命
3D打印技术的概念可能要追溯到上世纪四十年代的科幻小说,而真正的3D打印技术的发明人是谁也略有争议。1981年,日本的小田秀夫首次发表了利用激光光柱扫描光敏树脂进行3D模型构建的技术,并为之申请了专利,不幸的是该专利未获得授权,小田也因为资金问题没能继续开发该技术。与此同时,法国的工程师Olivier de Witte、Alain le Méhauté,和Jean-Claude André也在开发类似的技术,他们向法国国家科学研究中心(CNRS)申请了基金支持,并于1984年申请了专利。然而,CNRS也没有批准基金,项目也因为资金不足而停摆。终于,到了1986年,美国人查克·赫尔(Chuck Hull)申请到了立体光刻技术(stereolithography,SLA)的专利,创建了后来的3D打印行业巨头3D Systems,并于1987年发布了第一台3D打印机,命名为SLA-1,3D打印技术的时代开始了。
刚接触3D打印的小伙伴们可能会有这样一个问题:3D打印和增材制造到底是不是一回事?根据标准组织ASTM International的定义,两者就是同一技术在不同语境下的不同说法,3D打印偏向于民用领域,比如3D打印首饰、汽车、衣物等等;而增材制造则多用于工业领域,用来描述模具、零件、原型制造等。说到这里,小编还想简单地跟大家介绍一下三类3D制造技术,即成型制造、减材制造,和增材制造(图1)。如图1所示,成型制造是在模具中灌注材料,然后将材料固化成型,比如很多金属零件就是通过将熔融态的金属注入到模具中冷却固化,然后敲除模具得到的。减材制造则是对一块整体材料“做减法”,用机床等工具对材料进行切削、钻孔、打磨等操作获得产品的制造方式。减材制造中最重要的工具当然就是各种机床了。不同于成型制造需要提前构建模具,也不同于减材制造对原材料的浪费,增材制造是从0到1的制造过程,需要将材料以层层(layer-by-layer)叠加的方式进行堆积。由此我们不难发现,与其他两者相比,增材制造的方式不需要提前制备模具,也不会因为减材过程而浪费原材料,其“增材”过程更加灵活可控。更重要的是,增材制造可以任意使用多种材料制造同一物品,且对各材料的时空间分布进行精准的控制,这对于其他两种制造方式几乎是不可能的。
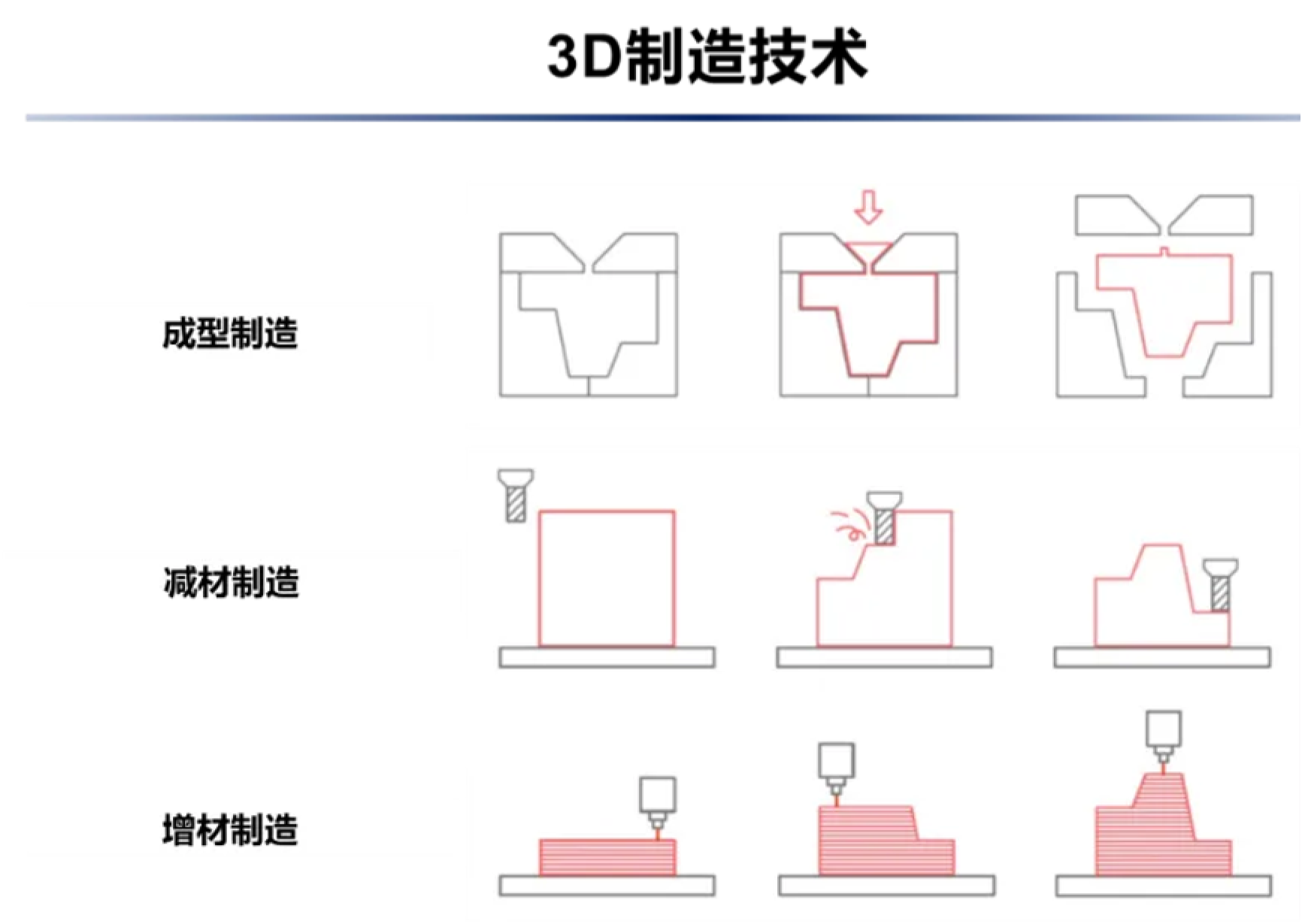
图1. 3D制造技术图示(图片来源:Ben Redwood等,2017)
3. 3D打印技术类型
3D打印的一般流程包括3D模型建立-模型切片处理-打印-后处理。我们的3D模型一般是STL格式的文件,然后将模型进行切片处理,就像大厨切土豆片一样把模型分成若干2D的平面切片,每一片对应的就是3D打印中的每一层。而后就是将切片文件导入打印机完成打印,最后将产品取出进行清洗、打磨、抛光等后处理。
根据3D打印中堆积材料的方式不同,我们可以将3D打印技术分为以下四类,分别是:挤出式(extrusion-based)、液滴式(droplet-based)、光固化式(vat-polymerization)和粉末式(powder-based)(图2)。挤出式打印是指运用气压、机械力等方式将材料挤出料筒进行材料层层堆积的打印技术,其中又包括打印线材的工艺熔融沉积制造(FDM,也可称作FFF)和打印流体的直写式打印技术。液滴式打印是利用压电、加热、激光等手段制造液滴并逐层堆积的方法,包括了连续喷墨(continuous inkjet)、按需喷墨(drop-on-demand inkjet),和激光诱导正向转移技术(laser-induce forward transfer)。光固化式则需要在一个装满光敏材料(树脂、水凝胶等)的液池中使用点光源(SLA)或面光源(数字光处理,digital light processing,DLP)进行逐层局部光固化,然后将结构件取出清除未固化材料。粉末式打印主要有两类,一类利用激光或高能电子束对粉末(金属、陶瓷、高分子材料等)进行逐层的局部烧结或融合;另一类粘合剂喷射成型技术(binder jetting,也可称作multi jet fusion,MJF)通过选择性地向粉末料池喷射粘合剂液滴,从而将特定位置的粉末粘接成一个整体。烧结或粘接的物件大多还需要后续的烧制过程,使得粉末材料的融合更好、机械强度更高。
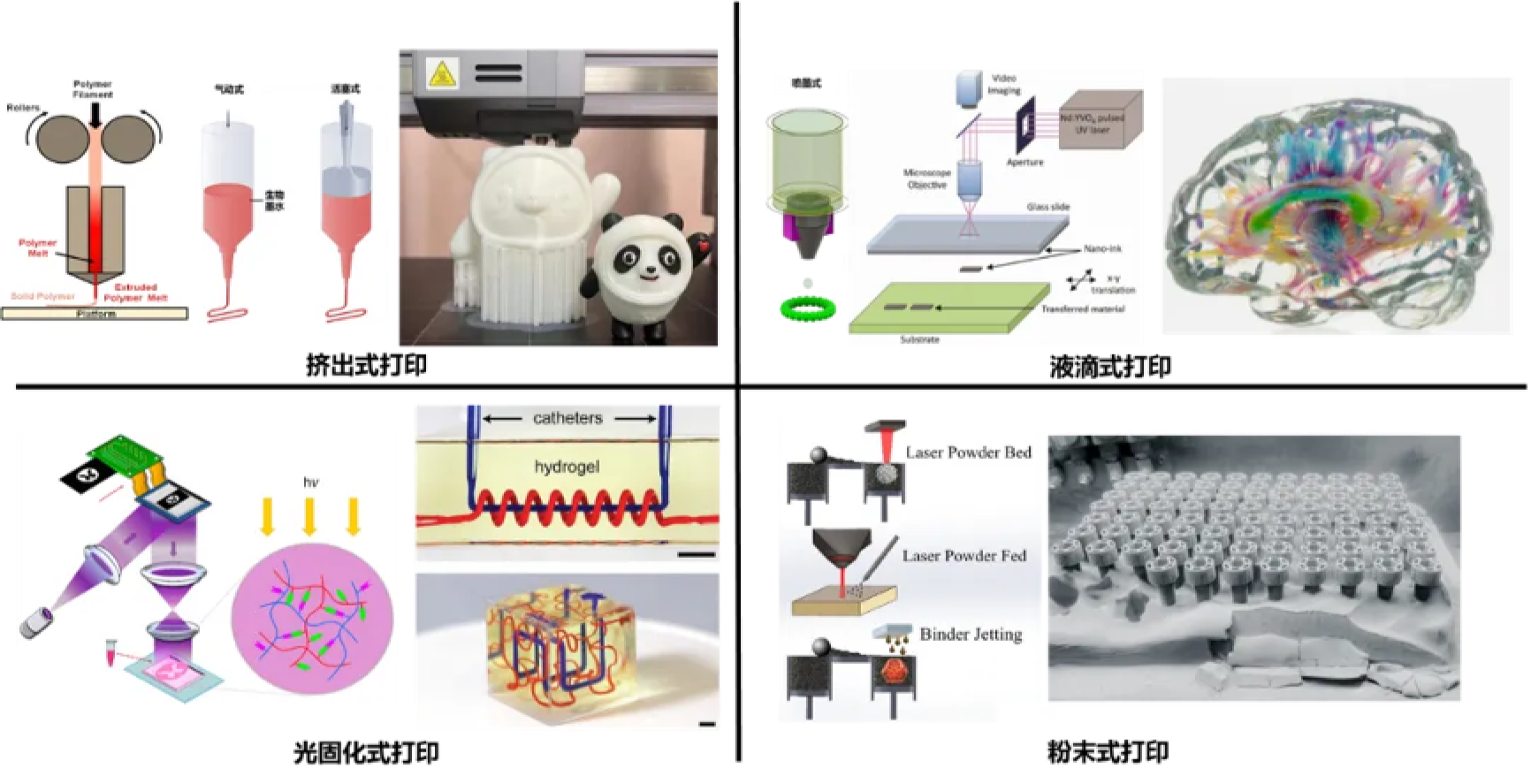
图2. 3D打印技术图示与实例(图片来源:Guvendiren 等, 2015; Zhang 等, 2021;https://www.chinaz.com/2022/0221/1366215.shtml;Ji 等, 2021;Serra 等, 2019;https://zhuanlan.zhihu.com/p/343772406;Yu等, 2020, Grigoryan 等, 2019;Fayazfar 等, 2018, https://amfg.ai/2019/07/03/metal-binder-jetting-all-you-need-to-know/,部分图片来源于网络,版权归原作者
4. 3D打印市场及应用
根据国际增材制造权威研究机构Wohlers Associates发布的增材制造产业报告《Wohlers Report 2022》,2021年全球3D打印产业总价值为152.44亿美元,其中制造服务类63.25亿美元,包括了航空航天、医疗、汽车、消费/电子等领域(图3)。目前3D打印技术正从原型制造向快速制造过渡,特别是在制造航空、汽车等机械元器件的技术逐渐成熟,正逐步取代成型制造和减材制造在制造业中的比例。从各大3D打印机公司的营收来看,全球前10名中美国独占4家并包揽了前三名,德国占3席,意大利1席,中国企业占2席,可见以Stratsys和3D systems为首的欧美公司依靠先发优势仍处在领先地位。
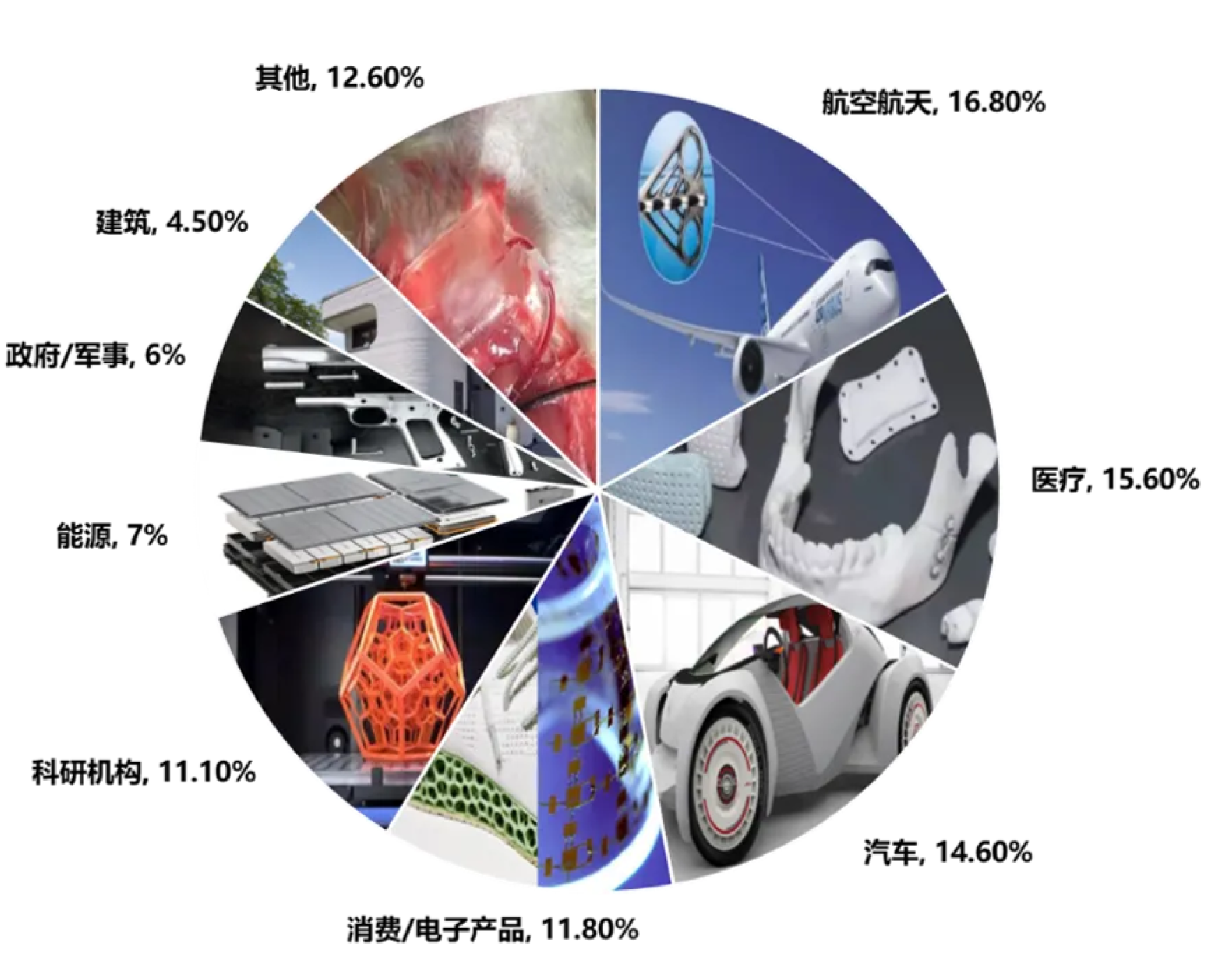
图3. 3D打印制造服务类行业占比示意图(数据来源《Wohlers Report 2022》,部分图片来源于网络,版权归原作者)
对于我们关注的生命科学和医疗领域,3D打印主要应用在牙科、医疗器械、手术模型、药物制剂、体外模型,以及器官制造方面。正如前面提到的,3D打印的灵活性和多材料制造方面无与伦比的优点决定了它在个性化定制产品市场中的优势,特别是针对病人的定制药品和医疗器械。对长期服用多种药物的病人,3D打印药物不仅可以方便病人服药,还可以构建药片内多孔结构改善药物的溶出特性。此外,从CT扫描等影像学数据可以得到病人器官3D模型,由此就可以通过3D打印的方式快速地构建1:1的解剖学模型,从而帮助医生设计手术流程,这可比传统的成型制造快多了。而针对牙科骨科临床需要的导板、移植物、矫正器等产品,3D打印可以快速地根据病人的需求将陶瓷、金属、高分子等材料制作成个性化器械。仅从2013年至2016年,4WEB Medical公司使用激光烧结制造的桁架系统植入物已经植入了超过10000名患者的身体。我国在3D打印医疗器械方面还处在追赶状态,截至目前药监局批准上市的3D打印医疗器械产品也多为牙科和骨科的模型或手术导板产品(图4)。
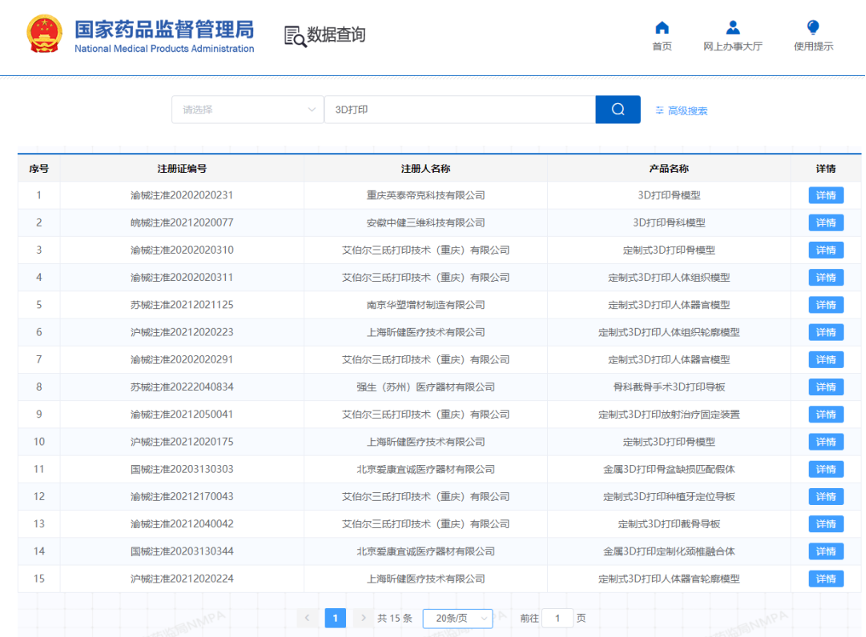
图4. 我国药监局批准的部分3D打印医疗器械清单(来源:国家药监局官方网站)
5. 由死到活,从形似到神似:3D生物打印的发展与突破
细心的你或许已经发现,为什么提到的临床应用都是牙科骨科呢?因为这些产品不需要有活细胞啊,技术成熟度高。比如假肢技术,或叫硬组织替代修复,其历史可以追溯至公元前,《春秋左氏传》“…国之诸市,履贱踊贵,民人痛疾…”中的“踊”即指假肢。
自SLA技术发明开始,基于病人影像学数据构建的器官解剖模型就用于外科手术设计和教学培训用途了。不同于普通的3D打印,生物3D打印需要含细胞的“生物墨水”作为打印的材料,所以打印过程必须相对温和,而且始终要保证细胞在含水的环境中,这也就大大提高了生物打印的难度。2004年,美国克勒门森大学的Thomas Boland团队改造了一台普通的喷墨打印机,将细胞、培养液、血清及其混合物排布成一定的样式并观察到了打印细胞的存活,这被认为是最早的生物打印实践,其细胞组装的样式还只是2D形式。值得注意的是,Boland教授的团队里培养出了Forgacs、Mironov、徐弢等生物3D打印界的先驱者,并且将专利授权给了organovo公司。
虽然Boland团队首次进行了细胞打印,说到推广生物3D打印器官概念的科学家,那就不得不提美国维克森林大学的Anthony Atala教授,这位秘鲁裔再生医学专家在1999年就开始采用组织工程支架和病人的细胞构建人工膀胱,拯救了很多孩子的人生。而在2013年,Atala教授将他带队开发的ITOP生物打印机带到了TED talks的节目现场,并演示了如何根据病人的CT数据打印一个同样形状、同样大小的肾脏,他手持人工肾脏的那一刻引来了全场观众的欢呼。特别是节目结尾,曾被人工膀胱救治的孩子走进现场,用亲身经历证明人工器官的光明未来,那一瞬间,好像人类已经获得了“换肾自由”。然而外行看热闹,内行看门道,膀胱和肾脏的复杂性和功能性并不在一个量级上,当时Atala教授手中的肾脏恐怕还不具备肾脏的基本功能,远不能满足器官移植的需要。

图5. Atala教授在TED Talk上展示打印的肾脏(图片源自TED Talk)
虽然Atala教授的研究极其重要,生物3D打印技术的专业也多次登上了TED talks的舞台,但是直到2019年,两篇生物3D打印技术的突破性进展才登上了科学杂志的主刊,标志着我们距离“换肾自由”又近了一步。卡耐基梅伦大学Adam Feinberg团队报道了“FRESH 2.0”打印方法构建了人的心脏组织和模型,其中动脉模型还具备了搏动的功能;莱斯大学的Jordan Miller团队则针对生物光敏材料设计了“SLATE”技术,构建了模拟肺泡的复杂管道结构模型,通过对肺泡模型的充气-排气过程模拟了人呼吸过程中的气体交换。两项技术的突破性一方面体现在对生物组织中精细结构的重建:两种技术分辨率都达到了10微米的数量级,且能完成多尺度、多曲率复杂结构的打印;另一方面体现在器官都表现出了特异性的功能,即心脏可以跳动,肺泡可以完成气体交换。
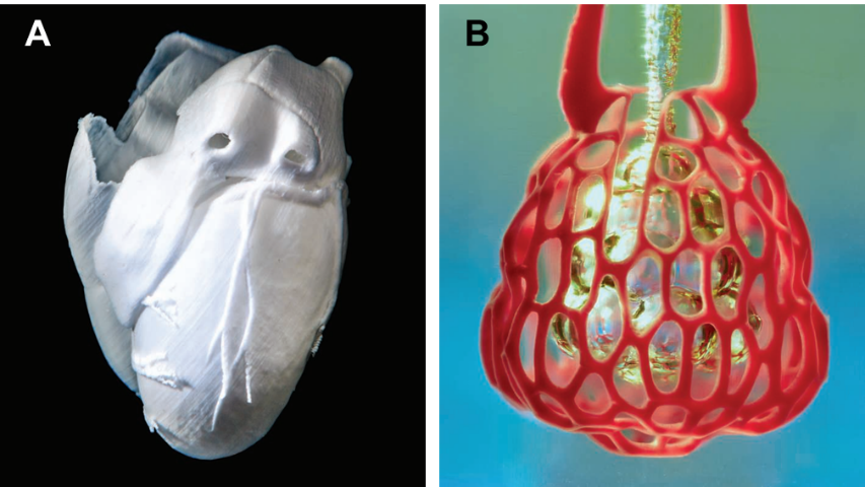
图6. 生物3D打印的突破进展:A. Feinberg团队使用FRESH 2.0方法打印的心脏模型;B. Miller团队用SLATE技术打印的肺泡模型。(图片来源:Lee等,Science,2019;Grigoryan等,Science,2019)
目前来看,人造组织/器官进入临床应用的主要瓶颈还是在于负载细胞的产品,说到这里,小编斗胆分析并预测一下各种组织和器官能够自由制造的时间点:对于骨骼、牙齿这样的硬组织,已经有很多支架类产品,即使需要负载细胞,其产品的上市应该不超过3年;对耳鼻喉这样的骨/软骨组织,由于同样不需要太多细胞的参与,产品大概也可以在5年内面世;到了软组织这边,对于功能比较单一,结构相对简单的角膜、血管、晶状体、瓣膜等,5年内应当会有临床级产品上架;而对于肝脏、肾脏、肌肉这样具有重复实质功能单元的组织或器官来说(肝脏里的肝小叶、肾脏里的肾单位、肌肉里的肌纤维束),10到20年应该是一个比较乐观的预期;最后我们要面对的就是心脏、肺脏、大脑这样关乎生命维持的关键器官。这样的器官不仅结构复杂,还要独立完成功能,更需要与体内的循环系统神经系统完美连接,即使是当前研究最多的心脏也要20年甚至更久的时间。Emmm,家祭无忘告乃翁吧。
与此同时,我国生物3D打印技术的发展不敢说是万物竟发吧,那也算是蓬勃发展,我国相关研究领域的研究论文数量仅次于美国,占全世界的14%(老美占29%),我们的研究队伍体量也仅次于美国,已经布局并积累了雄厚的技术和人才储备。但是我们还是要注意到我国在产业转化方面不及欧美,这也是多方面原因造成的。
6. 换肾自由有多难?难得过登月吗?
那么,体外构建一个可以移植的器官就这么难吗,难于上青天?还能比登上月球还难吗?
作为生物医学工程领域的工作者,小编无法直接比较器官制造与登月哪个更难,虽然直观来看,人类在50多年前就实现了登月,而器官制造可能还要几十年才能满足移植的需求。篇幅所限,小编在这也只能简单分析目前的问题所在。器官制造融合了细胞、生物材料、生长因子,而组装这三个组分的工具就是3D打印。目前器官制造最根本的问题可能还在于生命科学的局限性,即现有的培养体系不能很好的控制细胞的行为和命运。器官是多种细胞共同组成的三维复合体,其功能的表达需要各种细胞的协同作用。由于我们不能统筹调控各种细胞的行为,即使3D打印技术可以做到将细胞和材料按体内状态进行精准排布,打印结束后细胞仍然不能按体内的行为模式进行功能的表达,通俗的说就是我们东拼西凑攒了一台车,有柴油发动机、有自行车轮子、有皮卡车车壳、有一切部件,我们可以控制单一部件的形状,甚至我们单拉出来发动机也可以启动,但是我们的匹配度不高,这车吧,还是开不了……形似但缺少“灵魂”。
从细胞层面来看,我们还面临着细胞培养的能力和成本问题,以肝脏为例,人的肝脏大约有20-30亿细胞,如果用10 cm培养皿培养,需要上千个培养皿,没有自动化培养装置无法实现。即使我们降低细胞量,指望细胞在构建器官后自行增殖到目标数量,在这过程中的耗材成本也是难以接受的。对于生物材料,目前器官制造常用的水凝胶材料难以同时匹配人体器官对机械强度和生物活性的要求,也缺少可控的动态特性,其成本问题也不容忽视。而在技术层面,器官制造的一大瓶颈就是3D组织内血管网络的构建,虽然包括FRESH和SLATE在内的3D打印技术已经达到了10微米数量级,但仍然没有达到毛细血管级别组装精度,且不能同时满足多材料、高效构建高精度结构的要求。血管化之后器官还需要为它构建神经使之可以与体内神经系统连接。移植过程如何进行手术缝合,使人造器官和体内环境形成物理上和生物学功能上的无缝衔接,也是一大难题。此外,器官制造还面临如何监管以及伦理问题,当我们可以任意制造器官的时候,是不是意味着我们也可以组装人类?器官制造的终点是否是人造人?或许这才是我们面对的终极问题。
7. 总结与展望:困难与希望并存
叨叨了这么多,能看到这里的你或许已经是万中无一的科学奇才,小编在这为你点个赞,也希望你能为我们点个赞。虽然换肾自由看起来还很远,但是别忘了全世界最聪明的大脑们正夜以继日的为这个目标而努力着,也许哪天会出现生物3D打印界的达芬奇或薛定谔,能有更精巧的设计或能充分阐释制造生命的物理学原理。你我都可以冲这个方向努力,要么解决器官制造的问题,要么,活得久一点等到有人解决问题(调皮一下)。咱们下期见!
文案:季申、老顾
排版:武娟、黄文慧、王一帆
