巨噬细胞治疗肿瘤现状
在我们体内,免疫系统通常作为一个合格的安保部门,时刻巡防核查,及时发现并歼灭肿瘤细胞。然而,肿瘤细胞不会坐以待毙,它们使出各种手段蒙混过关,逃过免疫系统的监视,在人体内安营扎寨,克隆增殖。
因此,如果能增加消灭肿瘤细胞的免疫巡查员,更好地发挥免疫监视作用,那就能达到遏制肿瘤细胞逃逸,最终清除肿瘤的目的。而作为肿瘤相关免疫细胞中占比较大的重要部门,巨噬细胞也引起了众多科学家们的关注。
在此,我们对巨噬细胞治疗肿瘤的研究进展进行系统介绍。
1. 巨噬细胞在肿瘤中的作用
巨噬细胞激活的时候职责比较复杂,一般我们将它简化为两类:经典激活型巨噬细胞(M1)和交替激活型巨噬细胞(M2)[1]。
其中M1型巨噬细胞能杀伤肿瘤细胞和抵御病原体入侵,而M2型巨噬细胞在免疫调节和内稳态维持中发挥重要作用,如刺激Th2型免疫应答、消除寄生虫、促进伤口愈合和组织再生等。但是,在面对肿瘤的时候,M2型巨噬细胞就变成了叛徒,帮助肿瘤生长、侵袭和转移[2]。
通常情况下,如果肿瘤中M1型巨噬细胞较多,肿瘤恶性程度较低;反之,如果M2型巨噬细胞较多,那么肿瘤恶性程度较高,预后不佳[3]。
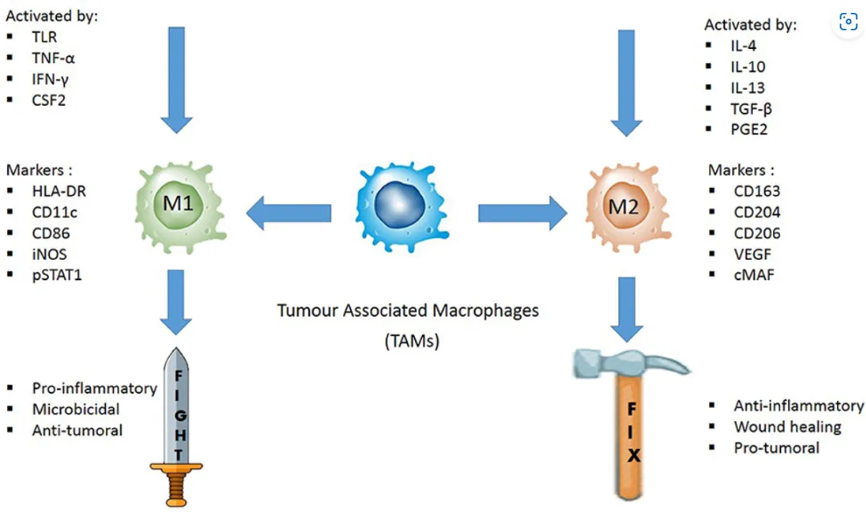
图1. M1型巨噬细胞和M2型巨噬细胞极化状态特征[4]
2. 巨噬细胞治疗肿瘤研究进展
2.1 单核细胞来源巨噬细胞研究进展
第一个使用体外培养巨噬细胞抗癌治疗的是德国雷根斯堡大学Andreesen团队。在20世纪80年代末,他们体外培养单核细胞来源巨噬细胞,临床治疗15名常规疗法失败的晚期癌症患者。
结果显示,尽管原发肿瘤组织没有完全消退,但部分患者在治疗后6个月内病情稳定。更重要的是,除了低烧和腹腔注射部位不适外,没有发现相关严重不良事件[5]。
然而,在类似上述的治疗中,天然巨噬细胞识别肿瘤相关抗原并吞噬肿瘤细胞的能力有限。巨噬细胞特性是会随着外界环境的变化而改变,因此在肿瘤组织中,巨噬细胞更倾向M2极化,抗肿瘤能力被“封印”。
2.2 CAR-巨噬细胞研究进展
目前,基因工程改造巨噬细胞是研究前沿和热点,其中富有前景的策略是构建嵌合抗原受体表达的巨噬细胞(CAR-M),推测其在实体肿瘤治疗中具有巨大的潜力。
在使用CAR之前,首先确认CAR对巨噬细胞功能的调控作用。2018年,美国加州大学Morrissey团队将CD19和CD22 CAR转染到鼠巨噬细胞系和鼠骨髓来源巨噬细胞中,实验结果证实CAR能显著增强吞噬肿瘤细胞的能力[6]。
在此基础上,美国宾夕法尼亚大学Klichinsky团队研究发现,嵌合腺病毒载体Ad5f35可以克服天然人巨噬细胞对病毒基因转导的固有抵抗力,能够重复、高效地转导天然人单核细胞和人巨噬细胞,且该CAR基因转导效率达75%以上。
Klichinsky团队对该CAR-M进行了系列测试,结果表明利用Ad5f35制备的CAR-M具有抑制肿瘤的能力。CAR介导的靶向抗肿瘤活性和抗原呈递能力,能启动体内多模式的抗肿瘤免疫应答[7]。
Klichinsky团队进一步开展了代号为CT-0508的CAR-M抗肿瘤临床试验,这是首次利用基因工程改造CAR-M细胞产品开展的人体试验。2021年9月,CT-0508获批实体瘤治疗快速通道,用来治疗复发性或转移性Her2阳性实体瘤。
2.3 工程化巨噬细胞研究进展
利用自体巨噬细胞开发基因工程化产品面临着一系列挑战,包括细胞数量有限、转染效率低、异质性高等,导致基因工程化巨噬细胞存在批次内和批次间质量差异。此外,永生化免疫细胞系不适用于临床,因此,科学家们开始寻求新的解题思路。
人胚干细胞(hESCs)和人诱导多能干细胞(hiPSCs)等人多能干细胞(hPSCs),具备扩增能力和可基因编辑性,是免疫细胞理想的种子细胞。浙江大学张进团队将CAR元件导入hiPSCs,分化获得巨噬细胞,命名为CAR-iMac。研究表明,在存在CD19等特异性抗原的情况下,CAR信号能够显著提高CAR-iMac吞噬肿瘤细胞的能力[8]。
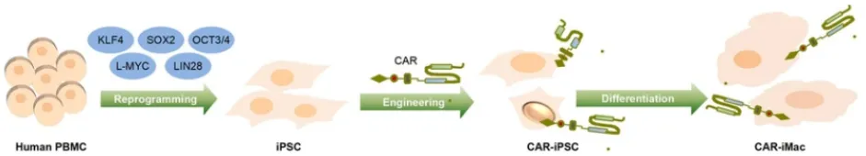
图2. CAR-iMac技术原理图[8]
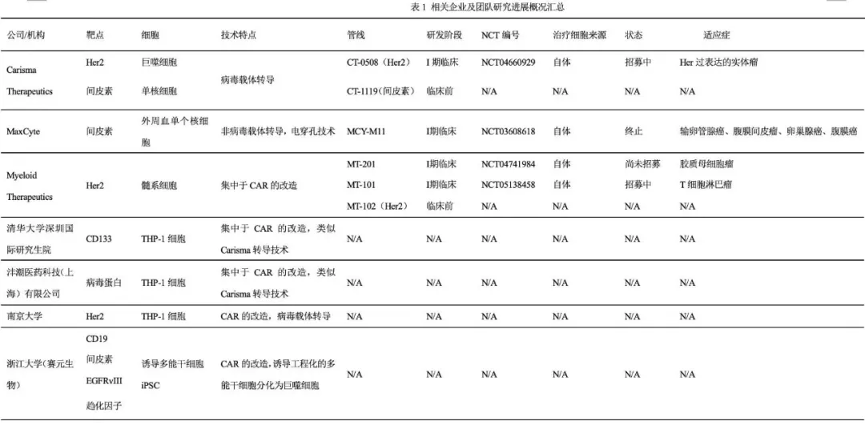
3. 相关企业及团队研究进展概况
目前,临床试验主要使用基因工程改造获得的CAR-M,包括骨髓/血液来源巨噬细胞和多能干细胞分化来源巨噬细胞。美国Carisma、MaxCyte及Myeloid Therapeutics的CAR-M项目进入Ⅰ期临床试验,其中Carisma的Her2靶点管线CT-0508进展最快。下表为处于研发过程的企业及团队概况:
4. 未来巨噬细胞治疗肿瘤的市场前景
政策驱动——得益于政府相关政策的大力支持,包括干细胞和免疫细胞在内的临床研究与成果转化不断推进,我国细胞治疗行业总体上进入快车道。
需求驱动——受不良生活习惯、环境污染等因素影响,肿瘤发病率持续增加,死亡人数不断攀升,造成严重的社会负担,这也驱动细胞治疗产品的发展。
技术难点——尽管推测巨噬细胞在治疗实体瘤方面具有优势,但相关研究还处于“婴儿期”,仍需突破诸多核心难点:
(1)巨噬细胞对常用病毒载体具有天然抗性,导致病毒载体感染巨噬细胞效率低,工程化改造难度高。
(2)巨噬细胞增殖能力远低于T细胞和NK细胞。在体外几乎不扩增,因此产量上不去,极大地限制其临床应用。
(3)巨噬细胞可塑性强,易受微环境影响。
受研究水平、技术手段等限制,目前CAR-M商业化水平较低,行业发展面临着诸多挑战。但CAR-M已在肿瘤治疗中崭露头角,相信随着科学技术的飞速发展,CAR-M将从实验室研究走入实际临床应用。
参考文献
[1]. Mosser D M, Edwards J P. Exploring the full spectrum of macrophage activation.Nat Rev Immunol 2008; 8: 958–69.
[2]. Atri C, Guerfali F Z, Laouini D. Role of human macrophage polarization in inflammation during infectious diseases. Int J Mol Sci 2018; 19: 1801.
[3]. Rhee I. Diverse macrophages polarization in tumor microenvironment. Arch Pharm Res. 201639(11): 1588-96.
[4]. Jayasingam S D, Citartan M, Thang T H, et al. Evaluating the Polarization of Tumor-Associated Macrophages Into M1 and M2 Phenotypes in Human Cancer Tissue: Technicalities and Challenges in Routine Clinical Practice. Front Oncol. 2020 Jan 24; 9: 1512.
[5]. Andreesen R, Scheibenbogen C, Brugger W, et al. Adoptive transfer of tumor cytotoxic macrophages generated in vitro from circulating blood monocytes: a new approach to cancer immunotherapy. Cancer Res 1990; 50: 7450–6.
[6]. Morrissey M A, Williamson A P, Steinbach A M, et al. Chimeric antigen receptors that trigger phagocytosis. Elife. 2018; 7: e36688.
[7]. Klichinsky M, Ruella M, Shestova O, et al. Human chimeric antigen receptor macrophages for cancer immunotherapy. Nat Biotechnol. 2020; 38: 947-953.
[8]. Zhang L, Tian L, Dai X, et al. Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions. J Hematol Oncol.. 2020;13: 153.
本文作者:李雪纯、刘晶晶、王柳
