小胶质细胞:微小的守护者
导言:
小胶质细胞是大脑中一类重要的非神经细胞,近年来备受科学界关注。它们作为大脑中的“微小守护者”,发挥着多种重要功能。本文将对小胶质细胞的定义、类型、结构和功能和一些知识进行科普,帮助读者更好地了解这个神秘而神奇的细胞群体。
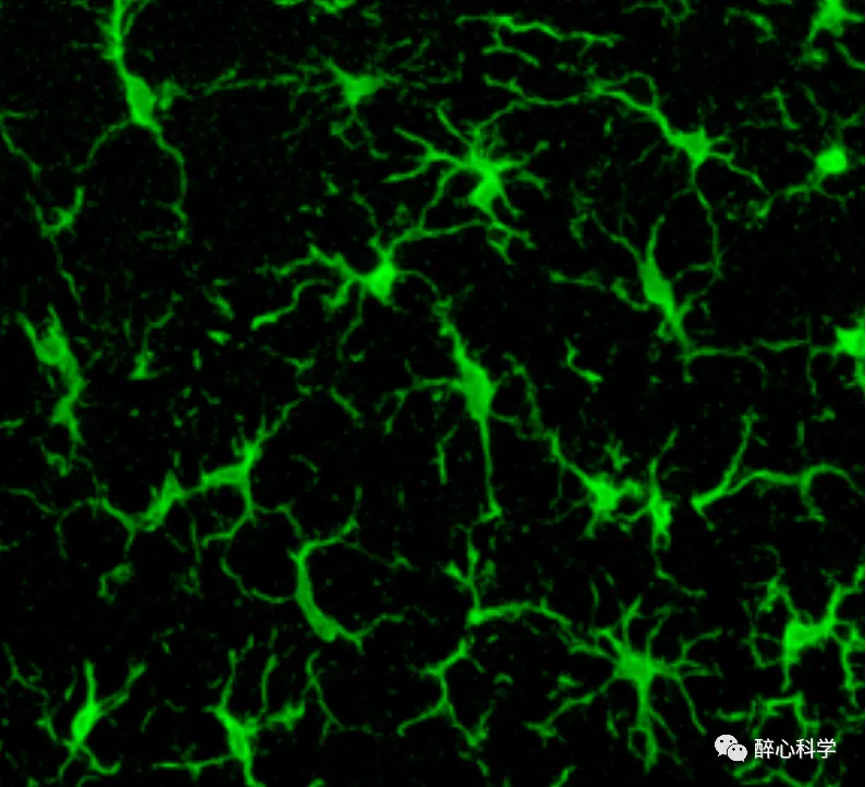
图1. 健康状态下的小胶质细胞
小胶质细胞的特点与功能
小胶质细胞(microglia)是中枢神经系统中的一类胶质细胞,占据了细胞总数的约10%。它们是神经系统中的主要免疫细胞,负责免疫监测、炎症应答和清除病理性细胞和有害物质。外形上,小胶质细胞具有独特的形态和功能特点:小胶质细胞通常具有细小的胞体,有多个分支突起。它们的形态在静息状态下呈现出细长的形状,但当受到刺激或免疫活化时,它们可以迅速变为巨噬细胞样态,胞体增大并伸出更多的突起。
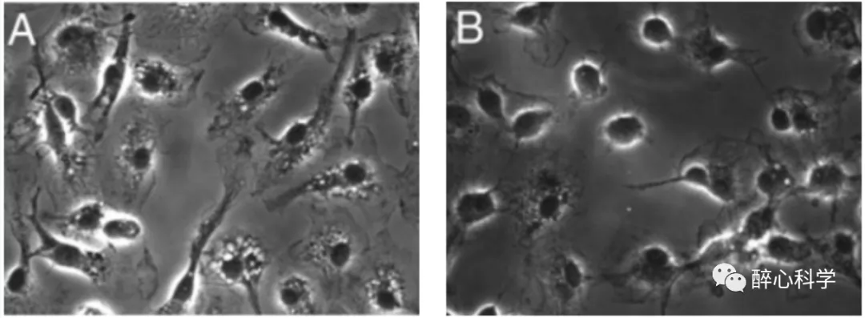
图2. 体外分离培养的小胶质细胞(A.静息状态;B.激活状态)【1】
功能上小胶质细胞在中枢神经系统中扮演着多种重要的功能角色。虽然它们数量较少,但它们对于神经系统的正常功能和健康至关重要。
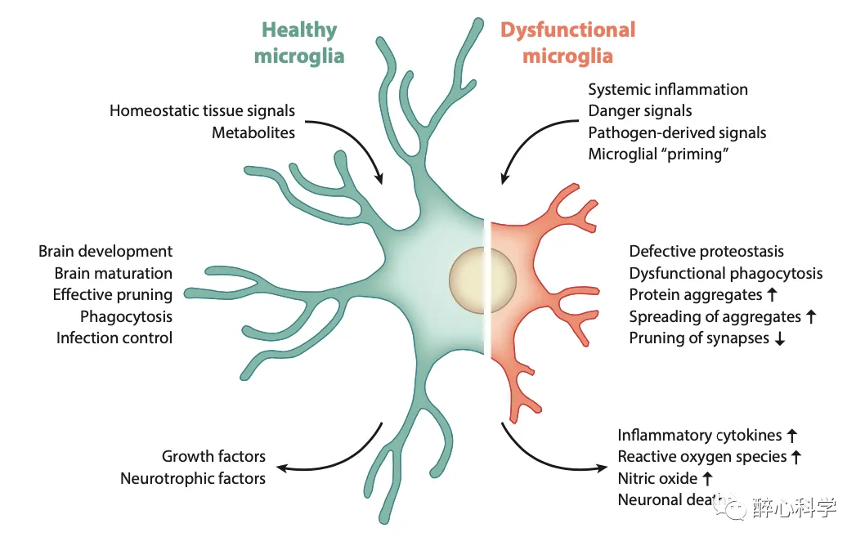
图3. 小胶质细胞功能多样性【3】
主要有以下功能:
1.稳态维持和免疫应答:小胶质细胞是中枢神经系统的主要免疫细胞,负责监测和应答神经组织中的病理变化和炎症。它们能够感知和识别细胞死亡、感染、损伤信号和异常蛋白聚集等,并对这些病理性变化作出免疫应答。
2.清除和吞噬功能:小胶质细胞具有清除和吞噬神经系统中的病理性细胞和有害物质的能力。它们能够吞噬和降解细胞碎片、异常蛋白质、细胞外沉积物等,并通过清除这些有害物质来维持神经组织的健康状态。
3.炎症调节:小胶质细胞在炎症反应中起着重要的调节作用。当神经系统遭受损伤、感染或炎症刺激时,小胶质细胞会被激活为巨噬细胞样态,并释放炎症介质和细胞因子。这些分子可以引导免疫细胞的迁移、调节炎症反应,并参与修复和恢复过程。
4.神经营养和代谢支持:小胶质细胞对神经元的营养和代谢支持至关重要。它们能够提供能量和营养物质,如葡萄糖和乳酸,以满足神经元的需求。此外,小胶质细胞还参与调节离子和神经递质的浓度,维持神经元的正常功能。
5.神经保护和修复:小胶质细胞在神经损伤和疾病状态下发挥重要的保护和修复作用。它们可以释放生长因子和神经营养因子,促进神经元的生存和再生,参与神经突触的重建和重塑,有助于神经组织的修复和恢复功能。
总体而言,小胶质细胞在神经系统中起着免疫监测、炎症调节、清除和吞噬、神经营养和代谢支持以及神经保护和修复等多个重要功能。它们与神经元、其他胶质细胞类型和免疫细胞之间相互作用,共同维持神经系统的正常功能和健康。
当谈到小胶质细胞时,以下是一些有趣的事实
1.小胶质细胞是在19世纪初被发现的。小胶质细胞的发现经历了一系列的研究和观察过程。
首先是卡哈尔的观察:1912年,西班牙的科学家圣地亚哥·拉蒙-卡哈尔(Santiago Ramón y Cajal)创立了世界领先的“卡哈尔学院”,在此之前,他已经以“神经元理论”享有盛誉。在卡哈尔学院的资助下,卡哈尔发明了一种新的染色方法,即硝酸铀-氯化金升华法,用于观察星形胶质细胞。在研究过程中,他还发现了另一类无法被染色的细胞,这些细胞较小,没有突起,并广泛分布于星形胶质细胞、血管和神经纤维之间。卡哈尔将这些细胞命名为“第三元素”。
其次是阿丘卡罗的研究:尼古拉斯·阿丘卡罗(Nicolás Achúcarro)是卡哈尔学院中最杰出的学生之一,他成为了年轻霍特加(Pío del Río-Hortega)的导师。阿丘卡罗是一个科学天才,他在游学期间建立了美国精神病医院的病理组织学实验室,并在回到卡哈尔学院后建立了自己的实验室。阿丘卡罗正在研究病人脑片中发现的柱状细胞和颗粒脂肪样细胞,并借助新发明的单宁-硝酸银氨染色法将它们与其他细胞区分开来。通过观察,阿丘卡罗推测柱状细胞具有吞噬性质,可以迁移并吞噬受损神经细胞,而颗粒脂肪样细胞则表现出不同的形态。这是对小胶质细胞功能的最早描述之一,然而由于当时染色方法的限制,阿丘卡罗无法观察到细胞的完整形态,因此无法确定这些细胞的来源。
霍特加的贡献:年轻的霍特加进入了卡哈尔学院组织病理学实验室,在阿丘卡罗的指导下学习并掌握了先进的染色法和显微成像技术。他参与了柱状细胞功能和起源的研究,并发表了许多关于组织病理学的研究论文。然而,不幸的是,阿丘卡罗很快被诊断出霍奇金淋巴瘤并去世,霍特加接任了实验室主任,并继续研究”柱状细胞”的起源问题。
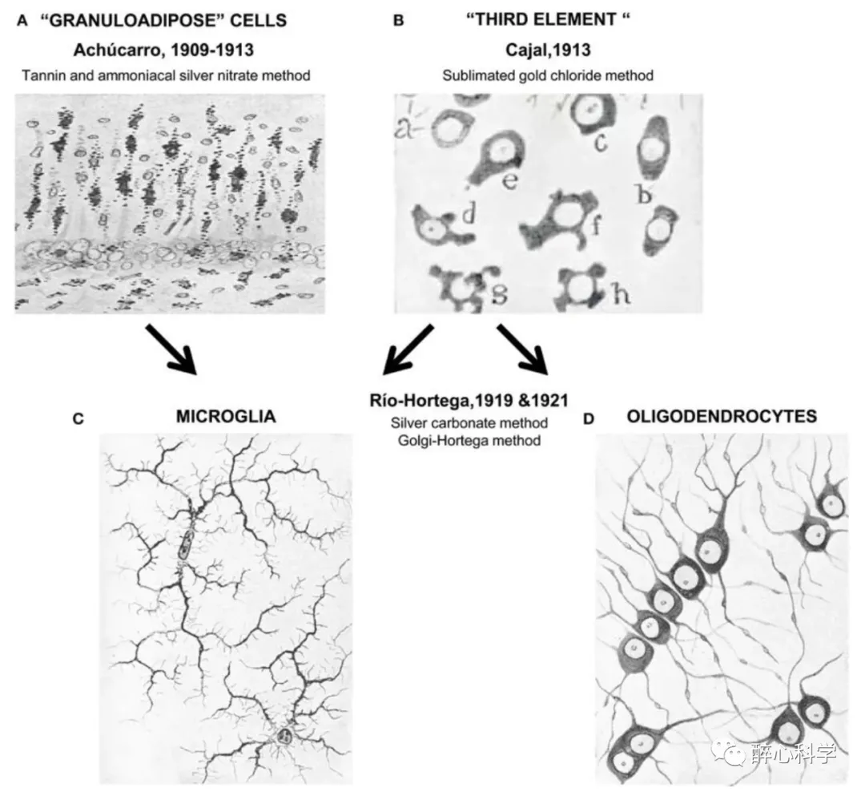
图4. 第三元素实际上是未被发现的小胶质细胞和少突胶质细胞[3a],[3b],A为阿丘卡罗观察到的颗粒状脂肪化的柱状细胞;B为卡哈尔观察到的第三元素;C为霍特加用碳酸银染色法观察到的小胶质细胞;D为霍特加用高尔基-霍特加染色法观察到的少突胶质细胞
通过卡哈尔、阿丘卡罗和霍特加等科学家的不断努力和研究,小胶质细胞逐渐被认识和理解。他们的工作为后来对小胶质细胞的研究奠定了基础,并为我们深入了解这一细胞类型的功能和重要性提供了重要的启示。
2.小胶质细胞起源
由于小胶质细胞在中枢神经系统中的位置和形态与其他胶质细胞相似,小胶质细胞的起源一直是科学界争论的焦点。之前,科学家们曾普遍认为所有神经胶质细胞都来自神经外胚层,尽管W. Ford Robertson和Santiago Ramon y Cajal曾怀疑小胶质细胞起源于中胚层。
然而,近年来的研究通过谱系追踪实验、共生实验和骨髓移植实验等方法,提供了新的证据来解决这个问题。这些研究显示,小胶质细胞是由卵黄囊产生的红骨髓前体细胞(EMPs)发育而来。EMPs分化为巨噬细胞,并通过迁移定植于E9.5天的胚胎大脑,进而形成小胶质细胞。这些实验结果提供了支持小胶质细胞起源于中胚层的证据[4]。
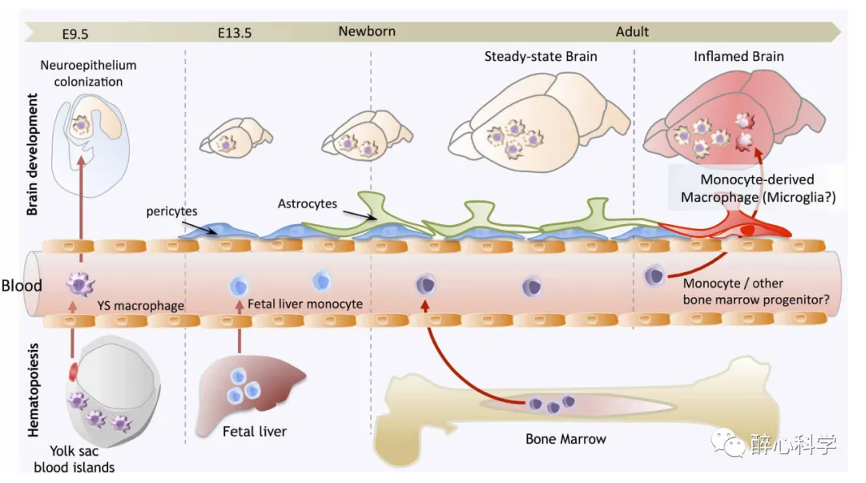
图5. 小胶质细胞起源示意图[5]
3. 小胶质细胞惊人的再生能力
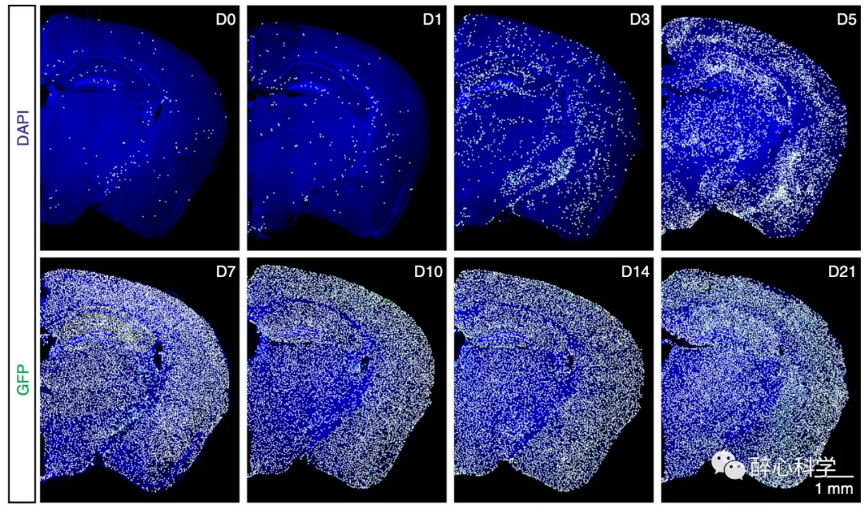
图6. 小胶质细胞再植现象[6]
在过去的几十年里,人们普遍认为成年哺乳动物的中枢神经系统(包括脑、视网膜和脊髓)具有非常有限的再生能力,尽管存在神经干细胞与少突细胞前体细胞,但由于中枢神经系统细胞内部特性和外部环境的限制,它们的分化能力有限,无法在神经退行性疾病(如脑外伤、老年痴呆和帕金森病等)中分化出足够数量的细胞来修复受损的中枢神经系统。因此,长期以来认为成年哺乳动物的脑损伤是无法修复的。
然而,在2014年,加州大学欧文分校的研究人员发现了令人惊讶的小胶质细胞再生现象,彻底改变了人们对中枢神经系统细胞再生的认知。他们通过特异性抑制集落刺激因子1受体(colony-stimulating factor 1 receptor, CSF1R)的方式几乎完全消除小胶质细胞(>99%),然后停止抑制并经过短暂恢复期后,发现脑内出现了新生的小胶质细胞[7]。这些再生的小胶质细胞能够快速定植于整个大脑,并在大约一周的时间内完全恢复其原有的密度、分布和形态。这是在成年哺乳动物中首次发现的大规模细胞再生现象,被称为小胶质细胞再植。研究团队通过免疫组织化学染色的方法推测,再植的小胶质细胞可能是由脑内一类短暂表达Nestin的细胞分化而来。这种细胞被认为具有外胚层谱系干细胞的特征,表明它们具有向不同谱系分化的高度潜能。
虽然这一发现引起了广泛关注,并在学术界产生了重要影响,但是关于再植小胶质细胞起源的问题仍然存在争议。目前学术界的争议主要集中在几个方面:是否存在成熟中枢神经系统中的跨谱系分化现象、再植小胶质细胞是否来源于血液细胞的分化,以及是否可能来源于残存的小胶质细胞。为了解决这些问题,研究人员采用了多种谱系追踪技术,通过连体结合手术、诱导型谱系追踪转基因小鼠和Cx3cr1-CreER::Ai14谱系追踪技术等,最终发现再植小胶质细胞完全来源于中枢神经系统内残存的原生小胶质细胞经过细胞增殖形成。
总结:
小胶质细胞仍存在一些未解决的问题。首先,小胶质细胞的发育和成熟机制仍不完全清楚。尚不了解小胶质细胞在胚胎发育和成年期之间的转变过程,以及它们与其他胶质细胞类型之间的关系。其次,小胶质细胞在不同脑区和不同病理状态下的异质性和功能差异性仍需要进一步研究。需要更多的了解不同亚群之间的分子标记、功能特性和相互作用机制。
尽管小胶质细胞的研究在动物模型中取得了许多重要进展,但在人类研究中存在一些限制。获取人类活体脑组织样本是一项具有挑战性的任务,因此我们对人类小胶质细胞的特性和功能了解有限。人胚胎干细胞(human embryonic stem cells, hESCs)是从早期人胚胎中获得的多潜能干细胞,具有自我更新和多向分化的能力。由于其具有广泛的分化潜能,人胚胎干细胞被认为是研究和解决人类小胶质细胞相关问题的一种有力工具。
参考引用:
[1]. Muffat J, Li Y, Yuan B, Mitalipova M, Omer A, Corcoran S, Bakiasi G, Tsai LH, Aubourg P, Ransohoff RM, Jaenisch R. Efficient derivation of microglia-like cells from human pluripotent stem cells. Nat Med. 2016 Nov;22(11):1358-1367. doi: 10.1038/nm.4189. Epub 2016 Sep 26. PMID: 27668937; PMCID: PMC5101156.
[2]. Hickman S, Izzy S, Sen P, Morsett L, El Khoury J. Microglia in neurodegeneration. Nat Neurosci. 2018 Oct;21(10):1359-1369. doi: 10.1038/s41593-018-0242-x. Epub 2018 Sep 26. PMID: 30258234; PMCID: PMC6817969.
[3a]. Tremblay MÈ, Lecours C, Samson L, Sánchez-Zafra V, Sierra A. From the Cajal alumni Achúcarro and Río-Hortega to the rediscovery of never-resting microglia. Front Neuroanat. 2015 Apr 14;9:45. doi: 10.3389/fnana.2015.00045. PMID: 25926775; PMCID: PMC4396411.
[3b]. https://mp.weixin.qq.com/s/IseUhPHXbKa8ElgGJgsenQ
[4]. Ginhoux F, Greter M, Leboeuf M, Nandi S, See P, Gokhan S, Mehler MF, Conway SJ, Ng LG, Stanley ER, Samokhvalov IM, Merad M. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 2010 Nov 5;330(6005):841-5. doi: 10.1126/science.1194637. Epub 2010 Oct 21. PMID: 20966214; PMCID: PMC3719181.
[5]. Ginhoux F, Lim S, Hoeffel G, Low D, Huber T. Origin and differentiation of microglia.Front Cell Neurosci.2013 Apr 17;7:45. doi: 10.3389/fncel.2013.00045. PMID: 23616747; PMCID: PMC3627983.
[6]. Huang Y, Xu Z, Xiong S, Sun F, Qin G, Hu G, Wang J, Zhao L, Liang YX, Wu T, Lu Z, Humayun MS, So KF, Pan Y, Li N, Yuan TF, Rao Y, Peng B. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nat Neurosci. 2018 Apr;21(4):530-540. doi: 10.1038/s41593-018-0090-8. Epub 2018 Feb 22. Erratum in: Nat Neurosci. 2021 Feb;24(2):288. PMID: 29472620.
[7]. Elmore MR, Najafi AR, Koike MA, Dagher NN, Spangenberg EE, Rice RA, Kitazawa M, Matusow B, Nguyen H, West BL, Green KN. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. 2014 Apr 16;82(2):380-97. doi:10.1016/j.neuron.2014.02.040. PMID: 24742461; PMCID: PMC4161285.
作者:刘京,2020年毕业于中国科学院动物研究所干细胞与神经再生研究组,获博士学位;中国科学院动物研究所博士后。主要研究方向为神经退行性疾病治疗与干细胞转化医学。
