使用带有GFP-RUNX1和mCherry-TCF7标记的诱导多能干细胞优化体外T细胞分化
2024-06-11
多能干细胞(PSC)体外分化成T细胞有望为癌症免疫疗法提供无限的T细胞来源,但由于无法高效获得功能成熟的终末分化T细胞,癌症免疫疗法的发展受到了限制。2024年6月10日,中国科学院动物研究所、北京干细胞与再生医学研究院赵同标团队在CELL PROLIFERATION期刊发表了题为“Optimizing in vitro T cell differentiation by using induced pluripotent stem cells with GFP-RUNX1 and mCherry-TCF7 labelling”的研究论文。在该研究中,他们建立了一种荧光报告人类诱导多能干细胞(iPSC)系,称为TCF7mCherry RUNX1GFP,其中,RUNX1和TCF7的内源性表达分别由GFP和mCherry的荧光图像来说明。利用这一细胞系,研究人员确定OP9-C1D3以1:3的比例结合,表达CXCL12的OP9细胞和表达DL4的OP9细胞的饲养细胞显著提高了iPSC分化为CD8 +T细胞的效率。此外,他们将靶向EGFR的嵌合抗原受体(CAR)设计到iPSC中。使用OP9-C1D3饲养层从这些iPSC分化而来的CAR-T细胞对肺癌细胞表现出有效的细胞毒性。作者们期待该平台能够帮助优化体外造血干细胞/祖细胞和T细胞的分化,以满足临床对这些细胞的需求。
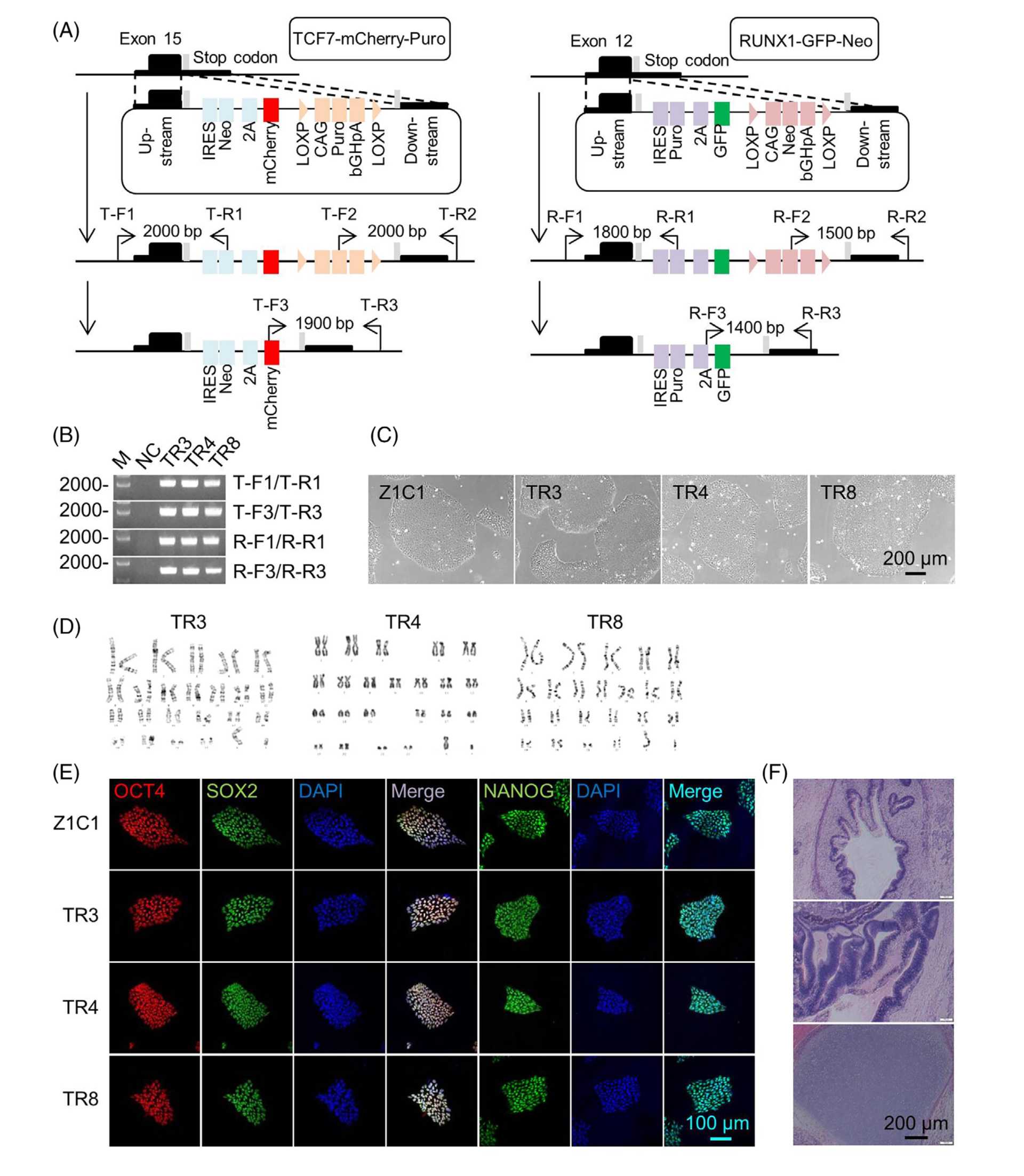
FIGURE 1. Generation of TCF7mCherryRUNX1GFP double knock-in iPSC (TR) lines.
原文链接:https://doi.org/10.1111/cpr.13661
