E3泛素连接酶RAD18的O-GlcNAc糖基化修饰促进跨损伤合成通路和同源重组修复
2024年5月8日,中国科学院北京基因组研究所郭彩霞和中国科学院动物所、北京干细胞与再生医学研究院唐铁山,以及首都师范大学李静共通讯在CELL DEATH & DISEASE期刊在线发表题为“RAD18 O-GlcNAcylation promotes translesion DNA synthesis and homologous recombination repair”的研究论文,报道了E3泛素连接酶RAD18结合OGT,并发生在Ser130/Ser164/Thr468位点发生O-GlcNAc糖基化修饰(O-GlcNAcylation),促进其跨损伤合成通路(TLS)和同源重组(HR)修复的功能。已知,RAD18应答DNA损伤的功能依赖其到损伤染色质的招募,作者发现S130A/S164A/T468A(3A)突变导致RAD18到激光微辐照(laser)、喜树碱(CPT)、博来霉素(Bleomycin)和UV诱发DNA损伤位点的募集均显著降低,提示RAD18 O-GlcNAc糖基化修饰可能参与调控其DNA损伤应答功能。
为了探究氧连N-乙酰葡糖胺修饰对RAD18 TLS功能的调控,作者通过染色质组分分离实验发现RAD18 3A突变导致PCNA单泛素化修饰水平明显降低。已知RAD18没有PCNA结合结构域(PIP box),它依赖接头蛋白如RPA、SIVA1、Polη、NBS1、RAD6等结合PCNA。为了揭示3A突变抑制PCNA单泛素化的分子机制,作者分别检测了RAD18与上述接头蛋白的相互作用。3A突变导致RAD18与Polη结合明显减弱,RAD18 O-GlcNAcylation促进其与Polη的结合。在机制上,3A突变体与CDC7结合降低,进而抑制了RAD18 Ser434位点磷酸化修饰,阻碍了Polη foci形成。另一方面,与野生型RAD18相比,回转3A突变体细胞的HR修复效率明显降低、CPT敏感性增加。为了揭示O-GlcNAcylation调控RAD18参与HR功能的分子机制,作者利用GST pulldown和免疫共沉淀发现,3A突变导致RAD18与泛素链、RAD51C的结合均明显减弱。O-GlcNAcylated RAD18对于重组酶RAD51募集到DSB位点具有促进作用。
总的来说,该论文发现RAD18的O-GlcNAcylation促进其在DNA损伤位点的募集,并应答UV和CPT损伤促进停滞复制叉处的PCNA发生单泛素化修饰和RAD51募集,有助于深入理解RAD18促进TLS和HR通路的功能和调控机制。
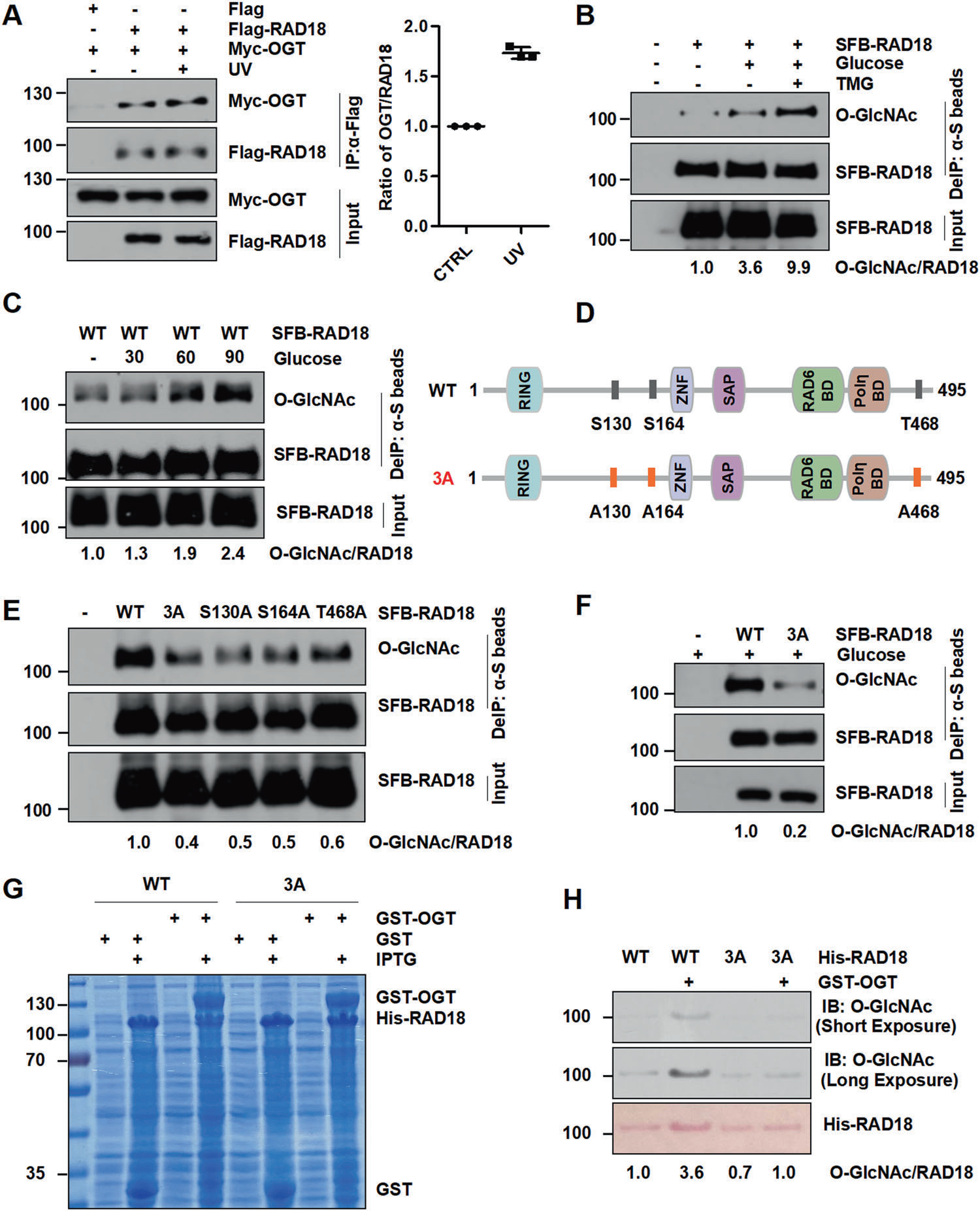
Fig 1. RAD18 binds OGT and is subject to O-GlcNAcylation predominantly at Ser130/Ser164/Thr468.
原文链接:https://www.nature.com/articles/s41419-024-06700-y
