研究揭示甲基转移酶Ezh2调控中枢神经再生新机制
2023年11月28日,原约翰霍普金斯大学医学院博士王学伟(现为美国南佛罗里达大学医学院助理教授),原约翰霍普金斯大学医学院周峰泉教授(现浙江大学求是讲席教授,医学院附属邵逸夫医院神经再生转化中心负责人),以及中国科学院动物研究所、北京干细胞与再生医学研究院刘长梅,共通讯在Journal of Clinical Investigation期刊发表题为“Histone methyltransferase Ezh2 coordinates mammalian axon regeneration via regulation of key regenerative pathways”的研究论文。研究发现在多种视网膜损伤模型后,Ezh2通过同时调控多个再生相关通路促进神经节细胞(RGCs)的生存和视神经再生。
作者首先观察到Ezh2蛋白水平在神经系统的发育成熟过程中表达量逐渐降低,预示它可能有促进轴突生长的功能。的确,成年外周感觉神经在损伤后能很快再生,研究发现Ezh2在坐骨神经损伤后在感觉神经元中表达显著增加。功能上,使用Advillin-Cre; Ezh2f/f小鼠在感觉神经元中条件性敲除Ezh2抑制自发的轴突再生。更重要的是,在没有再生能力的视网膜视神经节细胞中使用腺相关病毒载体高表达Ezh2可以大大促进神经元存活和视神经再生。另外一个有意思的发现是丧失甲基转移酶活性的Ezh2-Y726D突变蛋白仍然可以促进较弱的视神经再生和存活,表明Ezh2能以组蛋白甲基化依赖和非依赖的方式促进损伤后神经元存活和轴突再生。
为了更详细地研究Ezh2促进视神经再生的机制,作者联合使用RNA-seq和ATAC-seq分析过表达Ezh2后视神经节细胞转录组的变化。结果显示,Ezh2调控了多种神经再生相关机制,包括1)降低许多成年神经元高表达的基因,如突触相关基因和离子转运蛋白基因等;2)激活了许多发育神经元中促进轴突生长的基因表达;和3)下调多种轴突再生抑制因子或其受体的表达。因此高表达Ezh2可以在转录组水平上让成年神经元向年轻状态转变,从而提高其存活和再生能力。在众多差异表达的基因中,编码神经递质GABA转运蛋白Gat2的Slc6a13是下调最显著的基因之一。通过过表达或敲低Slc6a13基因表达,研究证明GABA转运蛋白是Ezh2下游介导其促进视神经损伤后再生充分必要分子。
综上所述,这项工作阐明了表观调控因子Ezh2通过同时改变神经元内源再生能力和对外源环境中的抑制因子的反应来调控哺乳动物中枢神经元轴突再生。该研究不仅发现了Ezh2及其下游基因在神经再生中的新功能,也更全面地揭示了调控神经再生的细胞分子机制,同时也对临床上CNS受损的患者的治疗与实验具有重要的参考意义。
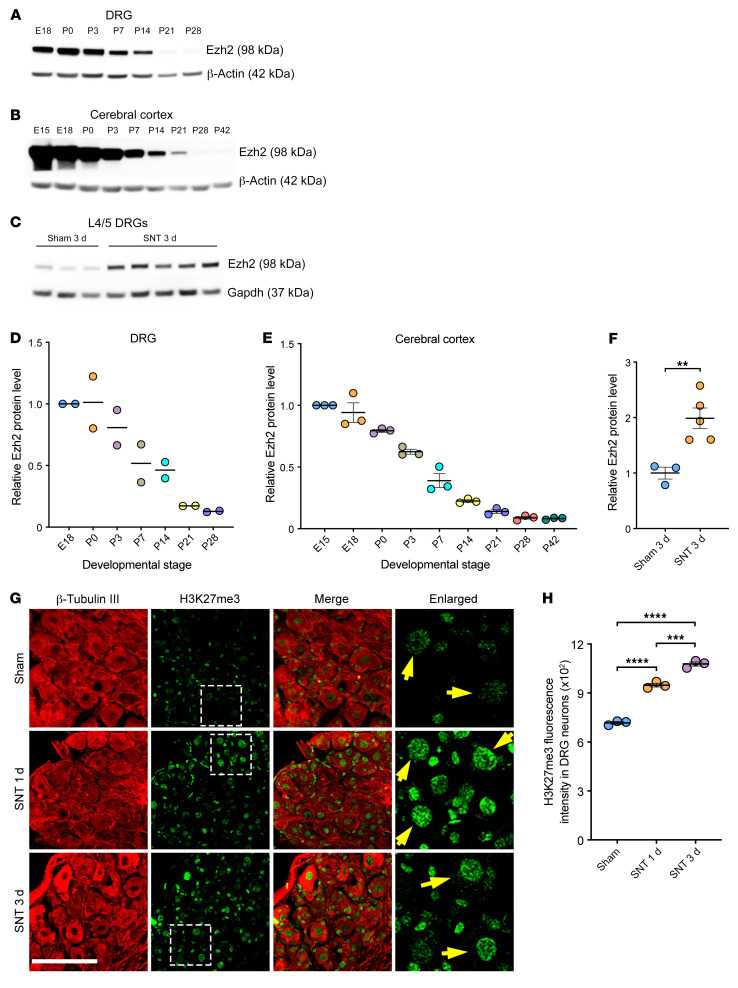
Figure 1. Ezh2 is developmentally downregulated in the nervous system and upregulated in DRG neurons following peripheral nerve injury.
原文链接:https://www.jci.org/articles/view/163145
